
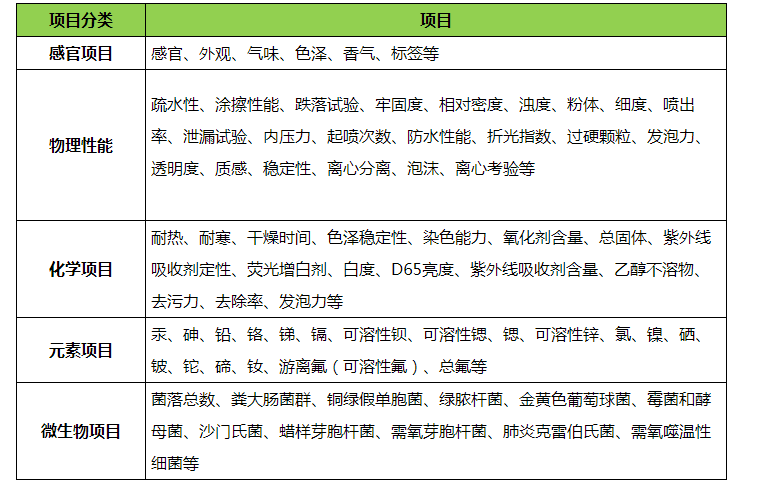
随(suí)着人们生活水平的提高,化妆品逐步(bù)进入了我们的生活,日常生活中我(wǒ)们人人都会(huì)与(yǔ)化妆品接触。由于我(wǒ)们(men)的使用频率较高,所以化妆品的质量好坏会影响我们的身体健康,我们需要重(chóng)视(shì)。化妆品检测主要是关注重(chóng)金属(shǔ)、微生物、抗生素、激素、毒理、抗生素、标准禁止添加项目等。
范围:
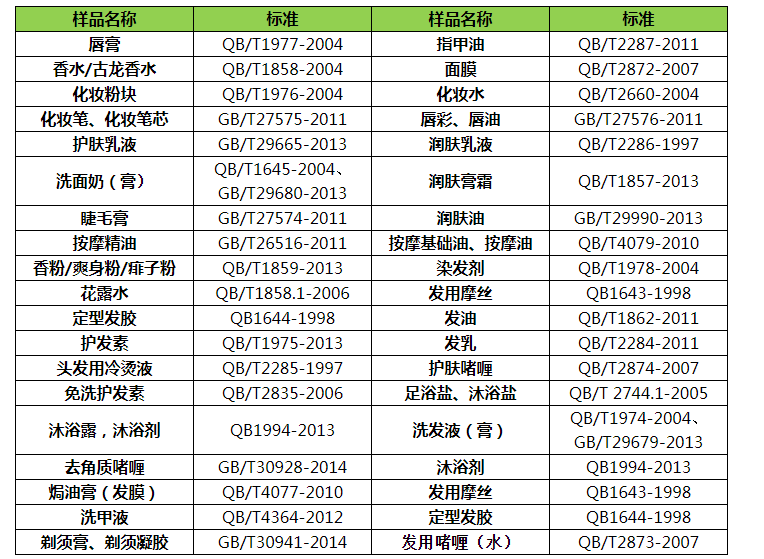
清洁类:牙膏、洗面奶(膏)、洗发液(膏)、香皂、足
浴盐/沐浴盐、沐浴剂等
护肤类:润肤乳液、润肤膏霜等
滋养类:化妆水、面膜、护发素、发乳、发油等
美容类:化(huà)妆粉块、唇膏、香水/古龙(lóng)水、香粉/爽身粉/痱子粉、定(dìng)型发胶、发(fā)用(yòng)摩丝、染发剂花露水、指(zhǐ)甲油等

化妆品非特备案
特殊用途化妆(zhuāng)品分(fèn)别是:育(yù)发、染发、烫发、脱毛、美乳、健(jiàn)美、除臭、祛斑和防晒9类化妆(zhuāng)品,除此之外的化妆品叫做非特殊用途化妆品,也就是普通化妆品。
一(yī)、凡在中华人民共和国境(jìng)内生产的非特殊用途化妆品(pǐn),生产企业应按本规定要求进行(háng)产品信息备案。
二(èr)、生产(chǎn)企业应当在产品上市销售前,将产品配方(不包括含量,限用物质除外)及销售包装(含(hán)产品标签、产品说明书)的信息按要求通过统一的网络平台报送至所在(zài)行(háng)政区域内的省级食品药品监(jiān)管(guǎn)部门。产品安全性(xìng)评估资料、产品生产工(gōng)艺(yì)简述、产品生产设备清单、产品技术要求及产品检验报告等资(zī)料(liào)由生产企业妥善保存备查。
三、委托生产的产品,委托双方应分(fèn)别向所(suǒ)在行政区域内的省级食品药品监督管理部门报送备案信(xìn)息。仅供出口的,由实际生产企业向所在行政区域内的省级食品药品监(jiān)督管(guǎn)理部门报送备案信息。
四(sì)、省级食品药品监(jiān)督管理部门收到企业(yè)的备案信息后,应当在5个工作日内完成对备案资(zī)料完(wán)整性的核查。符合要求(qiú)的,通(tōng)过国家食品药品监管(guǎn)总局政务网公布产品备案信息,供公众查询。
五、对于不(bú)属于备案产品范围的、备案资料(liào)不齐全或备案资料不符(fú)合规定形式的,省级(jí)食品药(yào)品监督管理部门应在(zài)5个工作日内告知企(qǐ)业并说明理由。存在明显违法情形的,应当责令立即改正(zhèng),不得上市销售。
六(liù)、省级食品(pǐn)药品监督部门应当在备案后三(sān)个(gè)月内组织开展对备案产品的实质审查,发现(xiàn)不符合(hé)国家相关(guān)规定的,应当依法予以查处。
七、已(yǐ)经备案的产品,拟变(biàn)更原备案事项的,应在变更前将相(xiàng)关变更信息报送备案。涉及备案管理部门(mén)改变(biàn)的,应主动申请注销原备案(àn)信息后,直接申请重新备案。
八、已获备(bèi)案(àn)的产品,自备案之(zhī)日起每满4年应重新按本规定要求提交产(chǎn)品备案信息。
九、产(chǎn)品配方信息(xī)的报(bào)送应符合以下要求:
1.全部原料应详细列明标准中文名称、原料序(xù)号、限(xiàn)用物质含(hán)量、使用目的等内容(róng)。
2.复配原(yuán)料应以复配形式(shì)填报,应标明各组分的标准中文名称。香精不须列明具体香料组分的种类和含量。
3.原料(含复配原料中的各组分)应按《国际化妆品原料标准中文(wén)名称目录》使用(yòng)标准中文名称,无国际化妆品原料名称(INCI)或未列入《国(guó)际(jì)化妆品原料标准中文名称目录》的,应使(shǐ)用《中国药典》中的名称或化学(xué)名称或植物拉丁学(xué)名,不得使用商品名(míng)或(huò)俗名(míng),但复配原料除外。
4.着色剂应提供《化妆品卫生规范》中载明的着色剂索引号(简(jiǎn)称CI号),无CI号(hào)的除(chú)外。
5.凡在产品配方中使(shǐ)用来源于石油、煤焦油的碳氢化合物的(单一组分的(de)除外),应标明相关原料的化学文摘索引(yǐn)号(简称CAS号(hào))。
6.使用动物脏器组织及(jí)血液制品提取物的原料(liào),应当收集该原料的来源、质量规格(gé)和原料生(shēng)产国允(yǔn)许使用的证明等资料存档备(bèi)查。
7.使用《化妆品卫生规范(fàn)》对限用物质有规格要求的原料,应当收集该(gāi)原料生产商出具的原料质量规格证明存档备查。
8.宣称为儿童或婴儿使用的(de)产品,配方设计原则(含配方整体分析报告)、原料的(de)选择原则和要求、生产工艺、质量控制(zhì)等内容应当按照(zhào)《儿(ér)童化妆品申报与审评(píng)指南》(国食药(yào)监保(bǎo)化[2012]291号)的要求编制,相关资料应当存(cún)档备查(chá)。
9、产品技术(shù)要求的编制参照(zhào)《关于(yú)印发化妆品产品技术要(yào)求规范的通知》(国食药监许[2010]454号)要求执行;检验要求参照《关于印发化妆品(pǐn)行政许可(kě)检验管理办法的通知》(国食药监许[2010]82号)执行,其中企业参照《关于印发化妆品中(zhōng)可能存在的安全性风险(xiǎn)物质风险评估指南的通(tōng)知》(国食药监许[2010]339号)要求进行风险评估(gū)并确认产(chǎn)品安全性的,可免做(zuò)毒理相关检测。
浙江和诺检测(cè)技术有限(xiàn)公司可以提供样品送检服务,进行非特备案的咨询和指导。
欧盟CPSR(化妆(zhuāng)品安全报告)
CPSR(化妆品安全报(bào)告)是产(chǎn)品进入欧(ōu)盟市场的通行证,欧盟化妆品新法规Regulation(EC)1223/2009已于2013年7月11日正式实(shí)施(shī),相比于之前的化妆品指令Directive 76/768 EEC,对化妆品的安全性(xìng)提出了更加严格的要求,其中明确规定(dìng)了产品必(bì)须完成化妆品安全报告(gào)(Cosmetic Product Safety Report,CPSR)后方能够在欧盟经济区上市销(xiāo)售。
根据新法规,欧洲化妆品协会(原Colipa)和欧盟委员会共同制定了化妆品安全报告指南,详细解读和(hé)列出了法规中关于CPSR的要求。该指南文件于2013年11月 25日由欧盟(méng)委员会作为委员会决议(yì)(Commission Decision)发布,欧盟委员会决议具有法律效(xiào)率,因此企业必须遵从该决议。目前进行的毒理学风险评估(Toxicological Risk Assessment,TRA)以及类似的简单升级版本已(yǐ)经不能够满足CPSR以及该指南的要求。指南更加细化了(le)新法规(guī)关于CPSR的要求(qiú)。增加的重要细(xì)则如下:
1. 产品配方中的各(gè)组分需提供准确的含量,若无法提供定量信息则按(àn)照高剂量计算。复杂成(chéng)分如提取物或生物(wù)制品等(děng)需提供纯(chún)度标准及测试方(fāng)法。
2. 产品中使用的原材料供应商须(xū)在报告中(zhōng)指出,香料和香(xiāng)精必须提(tí)供生产商和产品代码信息。
3. 化妆品包装材料需要(yào)满足食品接触材料(Food Contact Material)的标准并保证其稳定性。特别对于一些对光和空(kōng)气敏感的产品,其正确的贮(zhù)存(cún)方法需要在标签上得(dé)以体现。
4. 产品需要(yào)提供稳定性(Stability)报告,其中包括稳定性测定方法,防腐剂挑战试验报告,产品有效期(qī)以及开盖使用日期(Period-after-opening)。
5. 化妆品微生物方面的要求进一步细化,高风险的原(yuán)料需要注意微生(shēng)物危害。
6. 化(huà)妆品原料以(yǐ)及其包材中可能含有的杂质需要进行风险评估并证明其技术上(shàng)是不可避免的(如GMP条件(jiàn)下也无法避免)。
7. 化妆品所使用的原料需要提供详细的毒理档(dàng)案(Toxicological Profile of Substance,TPS),每一个原料需要提供其毒理学信息,包(bāo)括急性毒性、刺激性、过敏性等(děng)共12项毒理学(xué)端点。
8. 化妆品原材料和成(chéng)品的生产商都(dōu)需要达到GMP(ISO 22716)标准。 由于原(yuán)料中的杂(zá)质具有潜在的可以影响物质毒性(xìng)的风险因(yīn)素,因此在评估杂质的安全性时可以引入毒理学关注阈(yù)值(TTC)作为有效的评估手段。
9. 若出现不良反应,则需(xū)在报告中评估其发生的可能性和因果关系,出现严重的不良反应需上报欧盟成员国有关主管部门,并在CPSR报告中以附件形式存在并描述(shù)处理和解决方法。
10. 在评估报告结论中必须(xū)提到新的化妆品法(fǎ)规Regulation(EC)1223/2009,并(bìng)且(qiě)明确指(zhǐ)出产(chǎn)品(pǐn)是否符合新的化妆品(pǐn)法规。
11. 关(guān)于产品标签,警告(gào)用语(yǔ)和使用说明在满(mǎn)足新法规外还须(xū)参考相关文件,如 Commission Recommendation 2006/647/EC 及其它与标签相关的指导文件。为了直观地表达该内(nèi)容,可以(yǐ)在CPSR中附上产品的图片。
12. 毒理风险评估由定(dìng)性评估变为定量(liàng)评估。包括产品系统性的风险评估,配方组合后的兼容性,稳定性,微生物,包(bāo)装,标签以及使用等各个方面。产品所有的测试报告(gào)、技术文档和其它相关信息须经过毒理风险评估师评估,并特别注(zhù)意三岁以下儿童使用的(de)产品,除(chú)了满足新法规要求还需遵循欧盟消费(fèi)者安全科学委员会(SCCS)指南。
13. 当法律要求出现变化或更改时(shí),产品的原(yuán)材料发生改变(如更换供应商),使用条件发生改变,以及监测(cè)到在正常使用条件下不良(liáng)反应发生率增加时,毒理(lǐ)风险(xiǎn)评估师须对产品进行重(chóng)新评估,确保(bǎo)化妆品安全报告(CPSR)保持(chí)同步更新并满足新法(fǎ)规要(yào)求。
14. 指南对于可以出具化妆品安全报告(CPSR)的安全评估师资质(zhì)做了详细的定义,非(fēi)欧盟成员国承认的(de)药学,毒理学等相关专业人员不得从事化妆品(pǐn)安全报告评估(gū)工作。并(bìng)且评估师的资质及相关学历证明需要附在(zài)评估报告后。
相关(guān)信息/ RELATED INFO
MORE
服务热线
微信扫一扫


返回顶部